추천 콘텐츠
코로나19 백신은 RNA 치료법의 힘을 세상에 알렸다. 그리고 이 분자는 더욱 많은 비책을 감추고 있다.
분자생물학은 인기를 겨루는 무대가 아니다. 그러나 만약 그랬다면, 그것은 당파성을 보였을 것이다. 진화생물학자들은 DNA에 단체로 충성을 맹세했을 것이다. 규칙성을 갖춘 나선 안에 포함된 염기 서열에는 지구상의 거의 모든 생명체들의 이야기가 맞물려 있다. 반면에 보다 실용적인 성향의 약리학자들은 단백질에 투표할 것이다. 단백질은 염기 서열이 아니라 형태가 중요하다. 그것의 복잡성, 불규칙한 모양, 그들이 변화하는 방식들이 세포 안에서 이루어지는 거의 모든 생물학적 작용을 가능하게 만들어 준다. 그리고 거의 모든 약품이 각자의 효능을 갖는 이유는, 특정한 약물 분자들이 그러한 단백질의 형상에 맞는 방식이 있기 때문이다.
일반적으로 조력자 역할을 하는 분자인 리보핵산(RNA)을 따르는 이들은 소수에 불과할 것이다. DNA의 주된 목적이 RNA를 만드는 것이라고 주장할 수도 있다. RNA가 없었다면 단백질은 만들어지지 않았을 것이라는 점은 확실하다. 그러나 그들은 스타가 아니라 무대 뒤의 일꾼이다. 그들은 나무를 자르고 물을 가져다 놓는 등 열심히 일하지만, 화려하게 주목받는 일은 거의 없다. 그래서 그들을 높이 평가하는 것은 열정적인 추종자들뿐이다.
적어도 RNA로 만든 백신이 매일 전 세계에서 수백만 명의 사람들에게 코로나19에 맞서기 위한 방어막을 제공하기 전까지는 그랬다. 이제 무도회장에 신데렐라가 등장했다. RNA 백신은 현재 다른 모든 종류의 질병에서 사용하기 위해 고려되고 있을 뿐만 아니라, 다른 그 어떤 접근법에도 뒤지지 않는다. 약학 분야에서는 RNA의 다른 활용법도 역시 그 위력을 발휘하기 시작했다. 분자생물학이 의학에 적용되는 방식은 극심한 혁명의 격랑 속에 있는 것으로 보인다.
DNA의 이중 나선 구조가 발견된 이후 지적 혁명이 이어졌는데, 이 기간 동안 밝혀진 분자생물학을 하나로 통합하는 위대한 진실은, 형태와 서열의 세계가 서로 연결되는 방식이 있다는 것이다. 단백질의 형태는 그 단백질을 구성하는 아미노산의 사슬이 중첩되는 복잡한 방식에 따라 달라진다. 또한 그 사슬에서 다양한 유형의 아미노산들이 서로 연결되는 순서에 따라서도 달라진다. 그러한 아미노산의 순서가 세포의 게놈에 있는 DNA의 염기 서열에 저장된 유전 정보의 중요한 부분이다.
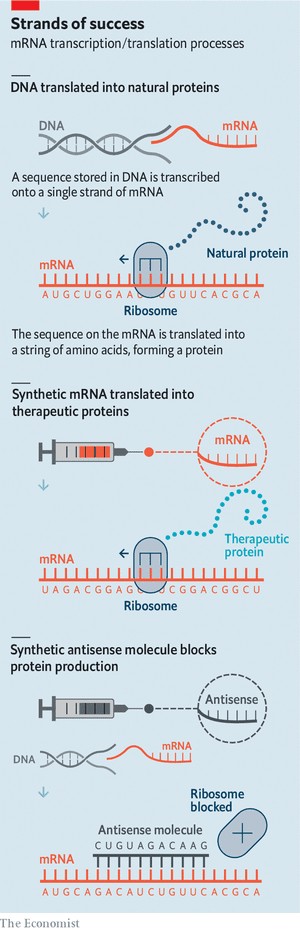
게놈 안에 저장된 고루한 문서 형태의 정보를 세포라는 기계 장치 안에 있는 능동적인 물질적 실체로 전달하는 것은 순서와 형태가 모두 중요한 역할을 하는 분자인 RNA에게 달려 있다. 유전자 염기 서열은 DNA에서 RNA로 제일 처음 복제된다. RNA가 전사(transcript)한 정보는 편집된 다음에 전령(messenger) RNA(mRNA)라는 분자를 만든다(표 참조).
일반적으로 조력자 역할을 하는 분자인 리보핵산(RNA)을 따르는 이들은 소수에 불과할 것이다. DNA의 주된 목적이 RNA를 만드는 것이라고 주장할 수도 있다. RNA가 없었다면 단백질은 만들어지지 않았을 것이라는 점은 확실하다. 그러나 그들은 스타가 아니라 무대 뒤의 일꾼이다. 그들은 나무를 자르고 물을 가져다 놓는 등 열심히 일하지만, 화려하게 주목받는 일은 거의 없다. 그래서 그들을 높이 평가하는 것은 열정적인 추종자들뿐이다.
적어도 RNA로 만든 백신이 매일 전 세계에서 수백만 명의 사람들에게 코로나19에 맞서기 위한 방어막을 제공하기 전까지는 그랬다. 이제 무도회장에 신데렐라가 등장했다. RNA 백신은 현재 다른 모든 종류의 질병에서 사용하기 위해 고려되고 있을 뿐만 아니라, 다른 그 어떤 접근법에도 뒤지지 않는다. 약학 분야에서는 RNA의 다른 활용법도 역시 그 위력을 발휘하기 시작했다. 분자생물학이 의학에 적용되는 방식은 극심한 혁명의 격랑 속에 있는 것으로 보인다.
신성의 발현
DNA의 이중 나선 구조가 발견된 이후 지적 혁명이 이어졌는데, 이 기간 동안 밝혀진 분자생물학을 하나로 통합하는 위대한 진실은, 형태와 서열의 세계가 서로 연결되는 방식이 있다는 것이다. 단백질의 형태는 그 단백질을 구성하는 아미노산의 사슬이 중첩되는 복잡한 방식에 따라 달라진다. 또한 그 사슬에서 다양한 유형의 아미노산들이 서로 연결되는 순서에 따라서도 달라진다. 그러한 아미노산의 순서가 세포의 게놈에 있는 DNA의 염기 서열에 저장된 유전 정보의 중요한 부분이다.
게놈 안에 저장된 고루한 문서 형태의 정보를 세포라는 기계 장치 안에 있는 능동적인 물질적 실체로 전달하는 것은 순서와 형태가 모두 중요한 역할을 하는 분자인 RNA에게 달려 있다. 유전자 염기 서열은 DNA에서 RNA로 제일 처음 복제된다. RNA가 전사(transcript)한 정보는 편집된 다음에 전령(messenger) RNA(mRNA)라는 분자를 만든다(표 참조).
mRNA 분자의 마지막 행보는 수십 개의 단백질들로 구성되어 다른 RNA 분자 집단의 주위에 늘어서 있는 복잡체인 리보솜(ribosome)이 인식할 수 있는 독특한 모양을 만드는 것이다. 한편, mRNA의 염기 세 개에 하나씩 달라붙는 tRNA라 부르는 작은 분자들이 아직 더 많이 남아 있는데, 리보솜은 이런 RNA 분자들의 도움을 받아서 유전자의 메시지를 단백질로 번역한다. 그리고 이 단백질이 아미노산 사슬을 만들면서 이 메시지가 전달된다.
독일 마인츠 소재의 생명 공학 회사인 바이오앤테크(BioNTech)와 미국 매사추세츠주 케임브리지 소재의 기업인 모더나(Moderna)가 코로나19를 일으키는 코로나바이러스를 물리치기 위해 개발한 RNA 백신들이 활용하는 메커니즘도 이와 동일하다. 이들 기업이 RNA 염기 서열을 대량 생산하는 방식은 코로나바이러스의 외부 세포막에 박혀 있는 ‘돌기(spike)’라는 독특한 단백질을 형성하는 것인데, 이것은 천연 mRNA처럼 보이기 위해서 특별히 설계되어 있다. 리포솜(liposome)이라는 작은 지방 거품들에 둘러싸인 이 RNA 분자들을 환자에게 주사하면, 리포솜이 mRNA를 세포 안으로 몰래 밀반입하게 된다. 그러면 (환자의 세포 안에 있는) 리보솜이 (그렇게 들어온) mRNA의 형태를 파악하고 그 염기 서열을 판독해서 돌기 단백질이 만들어진다. 환자의 면역 체계는 백신 접종을 받은 세포에서 만들어 내는 돌기 단백질을 인식하는 방법을 학습하고 그렇게 배운 기억 정보를 저장한다. 이렇게 해서 나중에 바이러스 입자 및 감염된 세포들의 표면에서 동일한 단백질을 마주하게 되면 신속한 대응을 이끌어 내는 것이다.
세포들로 하여금 DNA에 유전자가 포함되지 않은 단백질을 대량으로 만들도록 하는 능력은 그 자체로 새로운 치료법의 세계를 열어젖히기에 충분하다. 그러나 이것이 전부가 아니다. 세포들은 단백질에 대한 설명이 없는 RNA들을 엄청나게 많이 만들어 낸다. 이러한 RNA는 특정한 유전자 염기 서열을 인식하는 능력이 있기 때문에, 유전자의 번역 작업을 켜고 끄는 것을 포함해서 온갖 종류의 작업에서 유용하게 활용된다. 또한 머리핀이나 고리와 같은 특정한 모양으로 스스로를 접을 수 있는 능력이 있어서 단백질과의 상호 작용을 더욱 잘할 수 있다.
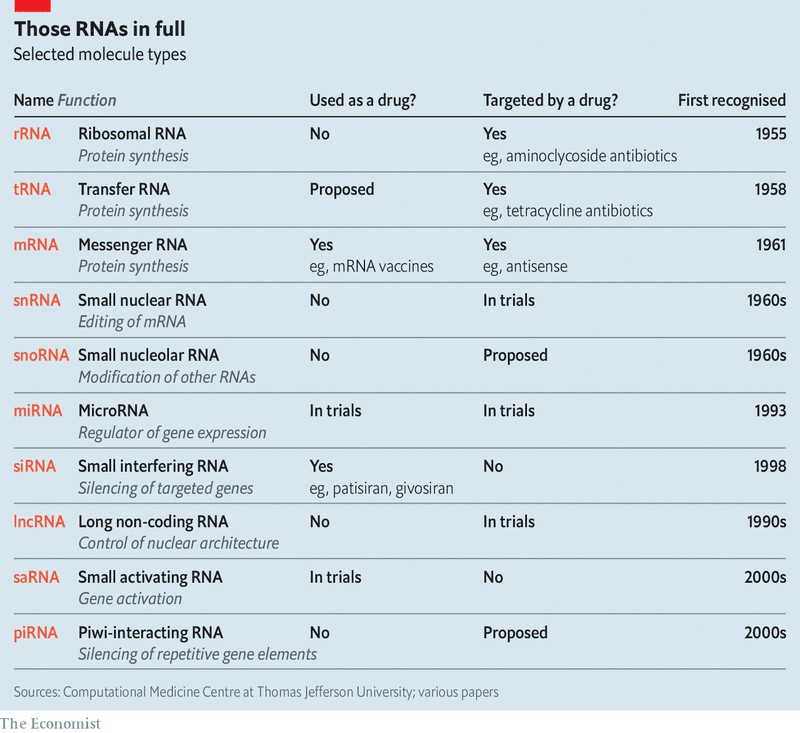
이처럼 수많은 알파벳들이 범벅된 RNA들(아래 표 참조)은 마치 컴퓨터의 운영 체제와 비슷한 기능을 하는 것으로 보이는데, 세포의 하드웨어와 소프트웨어 사이의 관계를 매개하는 것이다. 이것이 어떻게 작동하는지에 대한 세부 사항들의 상당수는 여전히 불분명한 상태이다. 그러나 일부는 충분히 파악된 상태여서, 그 운영 체제를 해킹해서 치료 목적으로 이용하기 위한 시도를 위해 수많은 지력과 자금을 들이붓고 있는 중이다.
독일 마인츠 소재의 생명 공학 회사인 바이오앤테크(BioNTech)와 미국 매사추세츠주 케임브리지 소재의 기업인 모더나(Moderna)가 코로나19를 일으키는 코로나바이러스를 물리치기 위해 개발한 RNA 백신들이 활용하는 메커니즘도 이와 동일하다. 이들 기업이 RNA 염기 서열을 대량 생산하는 방식은 코로나바이러스의 외부 세포막에 박혀 있는 ‘돌기(spike)’라는 독특한 단백질을 형성하는 것인데, 이것은 천연 mRNA처럼 보이기 위해서 특별히 설계되어 있다. 리포솜(liposome)이라는 작은 지방 거품들에 둘러싸인 이 RNA 분자들을 환자에게 주사하면, 리포솜이 mRNA를 세포 안으로 몰래 밀반입하게 된다. 그러면 (환자의 세포 안에 있는) 리보솜이 (그렇게 들어온) mRNA의 형태를 파악하고 그 염기 서열을 판독해서 돌기 단백질이 만들어진다. 환자의 면역 체계는 백신 접종을 받은 세포에서 만들어 내는 돌기 단백질을 인식하는 방법을 학습하고 그렇게 배운 기억 정보를 저장한다. 이렇게 해서 나중에 바이러스 입자 및 감염된 세포들의 표면에서 동일한 단백질을 마주하게 되면 신속한 대응을 이끌어 내는 것이다.
세포들로 하여금 DNA에 유전자가 포함되지 않은 단백질을 대량으로 만들도록 하는 능력은 그 자체로 새로운 치료법의 세계를 열어젖히기에 충분하다. 그러나 이것이 전부가 아니다. 세포들은 단백질에 대한 설명이 없는 RNA들을 엄청나게 많이 만들어 낸다. 이러한 RNA는 특정한 유전자 염기 서열을 인식하는 능력이 있기 때문에, 유전자의 번역 작업을 켜고 끄는 것을 포함해서 온갖 종류의 작업에서 유용하게 활용된다. 또한 머리핀이나 고리와 같은 특정한 모양으로 스스로를 접을 수 있는 능력이 있어서 단백질과의 상호 작용을 더욱 잘할 수 있다.
이처럼 수많은 알파벳들이 범벅된 RNA들(아래 표 참조)은 마치 컴퓨터의 운영 체제와 비슷한 기능을 하는 것으로 보이는데, 세포의 하드웨어와 소프트웨어 사이의 관계를 매개하는 것이다. 이것이 어떻게 작동하는지에 대한 세부 사항들의 상당수는 여전히 불분명한 상태이다. 그러나 일부는 충분히 파악된 상태여서, 그 운영 체제를 해킹해서 치료 목적으로 이용하기 위한 시도를 위해 수많은 지력과 자금을 들이붓고 있는 중이다.
제약 회사들은 단백질의 형체에서 염기 서열이라는 영역에 대해 오랫동안 연구해 왔지만, 이런 능력들은 이제 제약 회사들이 그 본류를 향할 수 있게 만들어 줄 것이다. 이전까지는 그들이 이미 존재하는 단백질들을 타깃으로 삼았다면, 이제 그들은 원칙적으로 유용한 신참들은 선수 명단에 집어넣고 해만 끼치는 오래된 선수들은 제외하면서 애초에 어떤 단백질이 만들어지는지를 통제하는 프로세스를 겨냥할 수 있다. 현재는 암이나 심장병, 수많은 유전적 장애들은 물론이고, 알츠하이머나 파킨슨병과 같은 두뇌 질환을 치료하기 위한 RNA 기반의 약물들이 임상 시험을 하고 있다.
또한 예전에는 어떤 약물을 찾아내기 위해서는 (그들이 만들어 낸) 작은 합성 분자의 형태가 그들이 겨냥하는 단백질의 구멍과 틈새에 맞는지를 확인하기 위해서 오랜 기간이 걸렸지만, 이제 RNA의 염기 서열과 형태에 대한 정보를 혼합한다는 것은 그간 수많은 영역에서 뒤죽박죽이었던 그러한 작업이 체계화될 수 있음을 의미한다. 어떤 유전자를 인식하는 데 이용되거나 그 일부를 형성하는 염기 서열은 다른 유전자에 맞춰진 염기 서열로 전환될 수 있다. RNA 약물의 작용이 그것의 염기 서열에 따라서 달라질 수 있다면, 그것의 타깃과 행동은 마우스 클릭만으로도 수정될 수 있을 것이다.
mRNA 백신을 판매하고 있는 두 기업은 모두 코로나19가 닥치기 전에도 이미 파이프라인(pipeline, 신약 개발 과정)에 다른 백신들을 보유하고 있었다. 지난해 1월 코로나바이러스 돌기의 유전자 염기 서열이 공개되자마자 그들이 살짝 방향을 틀어서 코로나바이러스를 정복하기 위한 노력에 곧바로 집중할 수 있었던 것도 이런 기술이 가진 장점의 일부이다. 이제 그들은 둘 다 그 전에 계획했던 작업을 진행하고 있다. 모더나는 현재 시트메갈로바이러스(cytomegalovirus, 신생아에게 신경학적 문제를 일으킬 수 있는 포진 바이러스)와 어린아이에게 호흡기 질환을 일으키는 호흡기 바이러스 세 가지, 그리고 열대 지역에서 주로 모기에 의해 전염되는 지카(Zika) 바이러스의 감염을 막기 위한 백신을 연구하고 있다. 바이오앤테크는 백신 개발에 좀 더 집중하고 있으며, 광범위한 암 치료와 같은 다른 치료법에 대해서도 연구하고 있다.
암세포는 그 표면에 특이한 별자리처럼 생긴 단백질을 갖는 경향이 있는데, 그중에서는 과대발현(overexpress)되는 일반적인 것들도 있지만, 좀 더 흥미로운 것은 해당 종양의 발달에 있어서 특별한 역할을 하는 변이 형태이다. 환자의 건강한 세포에서 나타나는 유전자를 종양 세포가 사용하는 그런 특이한 형태의 단백질과 비교하면, 암을 발생시키는 변이 단백질이 어떤 것인지가 드러난다. 그러면 그런 단백질에 있는 RNA들을 백신에 통합할 수 있다.
백신 접종의 결과로 생산되는 단백질들은 강력한 면역 반응을 일으킬 수 있는데, 이것은 암 그 자체는 하지 않는 작용이다. 종양이 성공적으로 자라난다는 것은, 신체의 면역 체계를 방해하는 활동을 전개한다는 것이기도 하다. 바이오앤테크의 공동 설립자인 외즐렘 튀레지(Özlem Türeci)의 말에 의하면, 이 회사의 암 치료를 위한 임상 시험에는 500명의 환자들이 등록되어 있다고 한다. 모더나도 비슷한 아이디어를 시험하고 있다.
바이오앤테크는 또한 과대발현되지만 변형되지 않는 단백질들을 겨냥한 mRNA 백신도 테스트를 하고 있다. 한편, 모더나는 인간에게 발병되는 암의 약 20퍼센트에 연루된 유전자인 KRAS에서 흔히 나타나는 변이에 의해 생성되는 단백질을 면역 체계가 식별할 수 있게 훈련시키는 백신을 연구하고 있다. 독일 튀빙겐 소재의 mRNA 관련 기업인 큐어백(CureVac)도 현재 시험 중에 있는 코로나바이러스 백신을 보유하고 있는데, 이들은 현재 비소세포(non-small-cell) 폐암에 대한 백신의 임상 시험을 진행하고 있다.
바이러스나 종양과 싸우기 위해서 mRNA를 투입하는 방법은 백신 접종만 있는 것은 아니다. mRNA 기술은 주사나 주입을 통해서 치료용 단백질인 인터류킨(interleukin)과 항체를 생산하는 세포들을 얻기 위해 사용될 수도 있다. 이러한 디자이너 항체(designer antibody)들을 산업적인 규모로 생산하기 위해서는 해야 할 일들이 엄청나게 많다. 그러나 만약 그것의 효능이 입증되고 환자들의 세포가 그런 항체의 생산 업무를 대신 수행하게 한다면, 그것은 거대한 진전이 될 것이다.
이처럼 어떤 자극을 받아서 치료 효과를 낼 수 있는 단백질들은 그 외에도 수많은 종류가 있다. 모더나와 제약업계의 대기업인 아스트라제네카(AstraZeneca)는 현재 협업해서 프로젝트를 진행하고 있는데, 이 프로젝트의 목표는 혈관의 재생을 촉진하는 단백질을 위한 mRNA를 만들어 내는 것이다. 현재 2상 임상 시험 단계에 있는 이 치료법의 아이디어는 심장마비를 겪은 이후에 심장에 새로운 혈관의 성장을 자극할 수 있다는 것이다.
신체가 항체나 성장 인자(growth factor)와 같은 단백질을 필요로 할 때 그것을 단기간에 생산할 수 있게 한다는 아이디어도 있다. 하지만 매일 필요로 하지만 유전자는 부족한 단백질들에 대해서는 어떨까? 유전자 치료법에서는 이러한 유전적 질환을 언제나 가장 명확한 목표로 삼아 왔다. 즉, 환자의 세포에 손실된 유전자를 추가하거나, 망가진 유전자를 수리함으로써 환자들에게 그 전까지 부족했던 단백질을 만들어 낼 수 있게 하는 것이다. 그러나 적어도 그러한 조건의 일부를 mRNA로 대신 처리할 수도 있을 것이다. 유전자를 삽입한다는 생각이 좀 더 우아해 보일 수는 있지만, 그것을 제자리에 맞게 주입하고 올바른 방식으로 작동하도록 규제하는 것은 어려운 과제이다. 만약 mRNA 치료가 그 일을 해낼 수 있다면, 아주 멋진 대안을 제시하게 될 것이다.
이런 이유들이 있기에 환자가 평생 동안 식단을 엄격히 제한해야 하는 신진대사 질환인 페닐케톤료증(phenylketonuria), 간과 신장이 커지고 아이들의 발육을 방해하는 글리코겐 축적병(glycogen-storage disease), 그리고 신체가 단백질과 지방을 제대로 분해하지 못해서 나타나는 질병인 프리피온산 혈증(propionic acidemia)과 메틸말로닌산 혈증(methylmalonic acidemia)을 mRNA로 치료하기 위한 연구들이 진행되고 있는 것이다. 이런 모든 질환들은 유전자 치료법에서도 들여다보고 있는 것들이다.
바이오앤테크, 큐어백, 모더나 등을 비롯한 기업들이 현재 모두 이러한 프로젝트들을 진행할 수 있었던 이유는, 이들이 각자의 기본적인 기반을 만들기 위해 오랜 시간을 투자해 왔기 때문이다. 그들은 많은 장애물을 통과한 끝에, 세포들이 저 너머에서 전해진 메시지를 받아들여서 거기에 적힌 메시지대로 행동할 수 있게 했다. 그리고 RNA가 면역 체계의 먹잇감이 되거나 세포 내부에서 분해되지 않도록 특별히 강화시켜야 했다. 이러한 메시지의 전달을 제대로 수행할 수 있는 적절한 지방질을 찾아내야 했는데, 때로는 간이나 림프절에 있는 특별한 조직에 맞게 다듬어야 했다. 그들의 노력이 완전히 무시되지 않을 수 있었던 이유는, 이러한 아이디어에 잠재력이 있었기 때문이다. 2018년 모더나의 기업 공개(IPO) 당시 이 회사의 가치는 75억 달러(8조 5072억 원)로 평가되면서 바이오테크 분야에서 신기록을 수립했다. 그러나 생명 공학 분야는 예상보다 더욱 엉망이며 생명 체계의 허점을 이용하려고 모색했던 사람들의 믿음과는 더욱 반대되는 것으로 판명 나는 경우가 많았던 오랜 역사를 갖고 있다.
RNA를 가지고 노는 장난이 그 전에도 폭발적인 인기를 누렸던 적이 있었기에, 이에 대한 회의론이 나오는 것도 어찌 보면 당연하다. 이 분야에서 가장 오래된 기업 중 하나인 아이오니스 파마슈티컬스(Ionis Pharmaceuticals)는 1989년에 설립되었다(이 회사의 이름은 원래 Isis Pharmaceuticals였지만, 이슬람국가가 이 이름을 사용하면서 현재와 같이 바뀌었다). 이 회사의 목표는 설립 당시나 지금이나 mRNA를 이용하는 것이 아니라 그것을 억제하는 것이다.
mRNA 분자의 염기 서열은 그것의 견본 역할을 했던 유전자에서 찾을 수 있는 것과 동일한 정보를 실어 나른다. 그러나 RNA가 만들어지는 방법 덕분에, 그것은 상호 보완적인 방식으로 그 정보를 전달한다. DNA는 시토신(cytosine)을 의미하는 C라는 염기를 갖고 있고, RNA는 구아닌(guanine)을 의미하는 G를 갖게 된다. 그리고 RNA는 C를 갖고 있다가 DNA가 G를 갖게 되는 식이다. 이렇게 상호 보완적인 가닥들은 서로에게 달라붙는다. DNA 분자가 이중 나선으로 쌍을 이루고 있는 이유도 그 때문이다. 어떤 mRNA에게 보완적인 염기 서열을 갖고 있는 분자를 소개해 주면, 이 둘도 역시 달라붙어서 mRNA를 무용지물로 만든다(위 표의 마지막 항목 참조).
다시 말하지만, 도움이 되는 방식으로 작동하는 멋진 아이디어를 얻어 내는 작업은 어려운 일이었다. 아이오니스가 역배열(antisense) 약물을 시중에서 정식으로 판매하기까지는 25년이 걸렸다. 이들은 현재 세 가지의 역배열 약물을 보유하고 있다. 그중 하나인 뉴시너센(Nusinersen)은 근육 소실 질환인 소아척수성근위축증(childhood spinal muscular atrophy)에 대해서 미국에서는 2016년에, 유럽에서는 2017년에 사용이 승인되었다. 그리고 이노테센(Inotersen)은 말초 신경계를 손상시키는 트렌스티레틴 관련 유전성 아밀로이드증(hereditary transthyretin-mediated amyloidosis·hATTR)에 대해서 2018년에 승인되었다. 마지막으로 볼라네소르센(Volanesorsen)은 유럽에서 2019년에 승인되었는데, 이 약물은 신진대사로 인해서 혈액 내의 트리글리세리드(triglyceride) 지방이 지나치게 증가한 사람들에게서 그 수치를 낮춰 준다.
아이오니스는 현재 추가적으로 여러 질환들에 작용하는 37개의 역배열 분자에 대한 임상 시험을 진행하고 있다. 그중 하나인 헌팅턴병(Huntington’s disease)[3]에 대해서는 스위스의 거대 제약 회사인 로슈(Roche)와 협업하여 연구를 진행하고 있다. 또한 근위축성 축삭경화증(amyotrophic lateral sclerosis)[4]과 알츠하이머병, 파킨슨병에 대해서는 신경 질환 치료 전문 기업인 바이오젠(Biogen)과 협업하고 있고, 겸상적혈구빈혈(sickle-cell anaemia)과 유사한 혈액 질환인 베타지중해빈혈(beta thalassaemia), 그리고 낭포성 섬유증(cystic fibrosis)에 대한 임상 시험도 진행하고 있다.
이 기업은 또한 또 다른 스위스 회사인 노바티스(Novartis)와 협업하여 지질단백질(a)[(lipoprotein(a))의 수치를 낮추는 방법을 개발하고 있는데, 지질단백질(a)는 저밀도지질단백질(LDL) 콜레스테롤 중에서도 특히나 파괴적인 형태이다. 이러한 지질단백질(a) 수치는 기존의 의약품으로는 치료할 수 없다. 여기에 대한 치료약으로 알려진 펠라카센(Pelacarsen)이 현재 3상 임상 시험을 진행하면서 그 수치를 변화시킬 수 있는지를 지켜보고 있다.
화학적으로 아주 조금만 손질을 하더라도 금세 리보솜에 친화적이지 않은 상태로 변하는 mRNA 분자들과는 다르게, 역배열 분자들은 상당히 많이 변형될 수 있어서 오래 유지되게 만들 수 있다. 아이오니스의 연구진은 이 역배열 분자들이 세포 내에서 몇 달 동안 돌아다닐 수 있도록 안정화시키는 방법에 대해서 연구를 진행해 오고 있다. 이것이 중요한 이유는 아이오니스가 겨냥하고 있는 목표들의 대부분이 지속적인 치료를 요하는 만성 질환이기 때문이다. 연간 주사 횟수가 적을수록 더 나은 것이다.
생명 공학 기업들이 1990년대에 역배열 분자에 대해서 열심히 연구하는 동안, 다른 분야의 연구자들은 자연에 그것과 유사한 기술이 있다는 사실을 발견했다. 그것은 바로 소간섭 RNA(siRNA)에 의해 유도되는 유전자 침묵(gene silencing)이라는 것이다. 2000년대 초기에 생명 공학 분야에서 유전자 침묵 기술의 붐을 이끌었던 곳은 2002년 미국 매사추세츠주의 케임브리지에서 설립된 앨라일람(Alnylam)과 그 이듬해에 샌프란시스코에서 뛰어든 서나세라퓨틱스(Sirna Therapeutics)이다.
애보트(Abbott), 머크(Merck), 노바티스, 화이자, 로슈, 다케다 등 기성 제약 회사들도 이 분야에 발 벗고 나섰는데, 대표적으로는 머크가 2006년에 서나세라퓨틱스를 10억 달러(1조 1339억 원)가 넘는 금액에 인수한 것이다. 이 분야에 거의 10년 동안 관심과 돈이 쏟아졌다. 그러나 전도유망한 단서들이 많이 있었음에도 불구하고, 이를 의약품으로 만드는 데는 실패했다. 2010년대 초가 되자 파티는 끝난 듯 보였다.
그러나 앨라일람은 춤추기를 멈추지 않았다. 2014년 그들은 머크로부터 서나세라퓨틱스가 남긴 성과를 헐값에 사들였다. 그들이 이 분야에서 처음 출시한 제품은 2018년에 선보인 hATTR 치료제인 파티시란(Patisiran)이었다. 현재는 그 외에도 기보시란(Givosiran)과 루마시란(Lumasiran)도 갖고 있는데, 이들도 역시 희소 유전 질환을 치료하는 약품이다.
이 기술을 사용해서 만든 네 번째 물질은 좀 더 폭넓은 매력을 갖고 있다. 그것은 바로 혈액 내의 LDL 콜레스테롤의 농도를 위험한 수준까지 밀어 올리는 유전성 장애를 치료하기 위해 만든 인클리시란(Inclisiran)이다. 전 세계적으로 대략 3000만 명의 사람들이 이 질환으로 고통받고 있다. 메디신스컴퍼니(Medicines Company)라는 회사가 앨라일람으로부터 인클리시란에 대한 라이선스를 받아서 이 제품을 시장에 내놓고 있다. 한편 노바티스가 2020년 1월에 메디신스컴퍼니를 97억 달러(10조 9969억 원)에 인수했는데, 지난해 말 유럽 연합에 제출된 허가 신청은 승인될 것으로 보인다.
앨라일람의 연구 개발 부문 사장인 아크섀이 베이슈나우(Akshay Vaishnaw)의 말에 의하면, 이 회사는 현재 또 다른 14개의 siRNA 약물을 임상 시험하고 있다고 한다. 이러한 약물이 대상으로 삼고 있는 것으로는 혈우병, B형 간염, 재발성 신장 결석 등이 있다. 캘리포니아의 패서디나에 소재한 애로우헤드파마슈티컬스(Arrowhead Pharmaceuticals)는 낭포성 섬유증(cystic fibrosis)을 겨냥한 것을 포함하여 여덟 가지의 잠재적 siRNA 약물을 임상 시험하고 있다. 매사추세츠의 렉싱턴에 있는 다이서나파마슈티컬스(Dicerna Pharmaceuticals)는 세 가지를 시험하고 있다.
이러한 siRNA 관련 연구는 형태와 염기 서열의 세계를 가로지르면서 이뤄진다. siRNA의 모양은 ‘RNA유도 침묵 복합체(RISC)’라 불리는 단백질들에게 꼭 들어맞는다. 그러나 이러한 siRNA의 일부는 이 복합체의 외부로 튀어나와 있다. 이 꼬리에 RNA의 염기 서열을 침묵시킬 수 있는 보완 염기 서열이 포함되어 있다. siRNA와 mRNA가 만나면, RISC에 있는 이 단백질이 전령(mRNA)을 잘게 부순다[박테리아에서 발견할 수 있는 것과 같은 방식으로 RNA가 유도하고 단백질이 실행하는 유전자 절단과 개념적으로 유사한 이 메커니즘은 현재 유전자 편집에 혁명을 일으키고 있는 크리스퍼(CRISPR, 유전자 가위) 도구의 기초이다].
식물과 무척추동물에서는 이러한 siRNA 메커니즘의 자연적인 기능이 명확하다. 바이러스와 연관된 mRNA를 잘라내는 것이다. 그러나 척추동물에게서는 그러한 기능을 제공하지는 않는 것으로 보이며, 그 대신에 무엇을 하는지에 대해서는 아무도 알지 못한다. 그런데도 의약품으로서의 유망한 가능성을 막지는 못하고 있다.
또한 예전에는 어떤 약물을 찾아내기 위해서는 (그들이 만들어 낸) 작은 합성 분자의 형태가 그들이 겨냥하는 단백질의 구멍과 틈새에 맞는지를 확인하기 위해서 오랜 기간이 걸렸지만, 이제 RNA의 염기 서열과 형태에 대한 정보를 혼합한다는 것은 그간 수많은 영역에서 뒤죽박죽이었던 그러한 작업이 체계화될 수 있음을 의미한다. 어떤 유전자를 인식하는 데 이용되거나 그 일부를 형성하는 염기 서열은 다른 유전자에 맞춰진 염기 서열로 전환될 수 있다. RNA 약물의 작용이 그것의 염기 서열에 따라서 달라질 수 있다면, 그것의 타깃과 행동은 마우스 클릭만으로도 수정될 수 있을 것이다.
의약품은 메시지다[1]
mRNA 백신을 판매하고 있는 두 기업은 모두 코로나19가 닥치기 전에도 이미 파이프라인(pipeline, 신약 개발 과정)에 다른 백신들을 보유하고 있었다. 지난해 1월 코로나바이러스 돌기의 유전자 염기 서열이 공개되자마자 그들이 살짝 방향을 틀어서 코로나바이러스를 정복하기 위한 노력에 곧바로 집중할 수 있었던 것도 이런 기술이 가진 장점의 일부이다. 이제 그들은 둘 다 그 전에 계획했던 작업을 진행하고 있다. 모더나는 현재 시트메갈로바이러스(cytomegalovirus, 신생아에게 신경학적 문제를 일으킬 수 있는 포진 바이러스)와 어린아이에게 호흡기 질환을 일으키는 호흡기 바이러스 세 가지, 그리고 열대 지역에서 주로 모기에 의해 전염되는 지카(Zika) 바이러스의 감염을 막기 위한 백신을 연구하고 있다. 바이오앤테크는 백신 개발에 좀 더 집중하고 있으며, 광범위한 암 치료와 같은 다른 치료법에 대해서도 연구하고 있다.
암세포는 그 표면에 특이한 별자리처럼 생긴 단백질을 갖는 경향이 있는데, 그중에서는 과대발현(overexpress)되는 일반적인 것들도 있지만, 좀 더 흥미로운 것은 해당 종양의 발달에 있어서 특별한 역할을 하는 변이 형태이다. 환자의 건강한 세포에서 나타나는 유전자를 종양 세포가 사용하는 그런 특이한 형태의 단백질과 비교하면, 암을 발생시키는 변이 단백질이 어떤 것인지가 드러난다. 그러면 그런 단백질에 있는 RNA들을 백신에 통합할 수 있다.
백신 접종의 결과로 생산되는 단백질들은 강력한 면역 반응을 일으킬 수 있는데, 이것은 암 그 자체는 하지 않는 작용이다. 종양이 성공적으로 자라난다는 것은, 신체의 면역 체계를 방해하는 활동을 전개한다는 것이기도 하다. 바이오앤테크의 공동 설립자인 외즐렘 튀레지(Özlem Türeci)의 말에 의하면, 이 회사의 암 치료를 위한 임상 시험에는 500명의 환자들이 등록되어 있다고 한다. 모더나도 비슷한 아이디어를 시험하고 있다.
바이오앤테크는 또한 과대발현되지만 변형되지 않는 단백질들을 겨냥한 mRNA 백신도 테스트를 하고 있다. 한편, 모더나는 인간에게 발병되는 암의 약 20퍼센트에 연루된 유전자인 KRAS에서 흔히 나타나는 변이에 의해 생성되는 단백질을 면역 체계가 식별할 수 있게 훈련시키는 백신을 연구하고 있다. 독일 튀빙겐 소재의 mRNA 관련 기업인 큐어백(CureVac)도 현재 시험 중에 있는 코로나바이러스 백신을 보유하고 있는데, 이들은 현재 비소세포(non-small-cell) 폐암에 대한 백신의 임상 시험을 진행하고 있다.
바이러스나 종양과 싸우기 위해서 mRNA를 투입하는 방법은 백신 접종만 있는 것은 아니다. mRNA 기술은 주사나 주입을 통해서 치료용 단백질인 인터류킨(interleukin)과 항체를 생산하는 세포들을 얻기 위해 사용될 수도 있다. 이러한 디자이너 항체(designer antibody)들을 산업적인 규모로 생산하기 위해서는 해야 할 일들이 엄청나게 많다. 그러나 만약 그것의 효능이 입증되고 환자들의 세포가 그런 항체의 생산 업무를 대신 수행하게 한다면, 그것은 거대한 진전이 될 것이다.
이처럼 어떤 자극을 받아서 치료 효과를 낼 수 있는 단백질들은 그 외에도 수많은 종류가 있다. 모더나와 제약업계의 대기업인 아스트라제네카(AstraZeneca)는 현재 협업해서 프로젝트를 진행하고 있는데, 이 프로젝트의 목표는 혈관의 재생을 촉진하는 단백질을 위한 mRNA를 만들어 내는 것이다. 현재 2상 임상 시험 단계에 있는 이 치료법의 아이디어는 심장마비를 겪은 이후에 심장에 새로운 혈관의 성장을 자극할 수 있다는 것이다.
신체가 항체나 성장 인자(growth factor)와 같은 단백질을 필요로 할 때 그것을 단기간에 생산할 수 있게 한다는 아이디어도 있다. 하지만 매일 필요로 하지만 유전자는 부족한 단백질들에 대해서는 어떨까? 유전자 치료법에서는 이러한 유전적 질환을 언제나 가장 명확한 목표로 삼아 왔다. 즉, 환자의 세포에 손실된 유전자를 추가하거나, 망가진 유전자를 수리함으로써 환자들에게 그 전까지 부족했던 단백질을 만들어 낼 수 있게 하는 것이다. 그러나 적어도 그러한 조건의 일부를 mRNA로 대신 처리할 수도 있을 것이다. 유전자를 삽입한다는 생각이 좀 더 우아해 보일 수는 있지만, 그것을 제자리에 맞게 주입하고 올바른 방식으로 작동하도록 규제하는 것은 어려운 과제이다. 만약 mRNA 치료가 그 일을 해낼 수 있다면, 아주 멋진 대안을 제시하게 될 것이다.
이런 이유들이 있기에 환자가 평생 동안 식단을 엄격히 제한해야 하는 신진대사 질환인 페닐케톤료증(phenylketonuria), 간과 신장이 커지고 아이들의 발육을 방해하는 글리코겐 축적병(glycogen-storage disease), 그리고 신체가 단백질과 지방을 제대로 분해하지 못해서 나타나는 질병인 프리피온산 혈증(propionic acidemia)과 메틸말로닌산 혈증(methylmalonic acidemia)을 mRNA로 치료하기 위한 연구들이 진행되고 있는 것이다. 이런 모든 질환들은 유전자 치료법에서도 들여다보고 있는 것들이다.
바이오앤테크, 큐어백, 모더나 등을 비롯한 기업들이 현재 모두 이러한 프로젝트들을 진행할 수 있었던 이유는, 이들이 각자의 기본적인 기반을 만들기 위해 오랜 시간을 투자해 왔기 때문이다. 그들은 많은 장애물을 통과한 끝에, 세포들이 저 너머에서 전해진 메시지를 받아들여서 거기에 적힌 메시지대로 행동할 수 있게 했다. 그리고 RNA가 면역 체계의 먹잇감이 되거나 세포 내부에서 분해되지 않도록 특별히 강화시켜야 했다. 이러한 메시지의 전달을 제대로 수행할 수 있는 적절한 지방질을 찾아내야 했는데, 때로는 간이나 림프절에 있는 특별한 조직에 맞게 다듬어야 했다. 그들의 노력이 완전히 무시되지 않을 수 있었던 이유는, 이러한 아이디어에 잠재력이 있었기 때문이다. 2018년 모더나의 기업 공개(IPO) 당시 이 회사의 가치는 75억 달러(8조 5072억 원)로 평가되면서 바이오테크 분야에서 신기록을 수립했다. 그러나 생명 공학 분야는 예상보다 더욱 엉망이며 생명 체계의 허점을 이용하려고 모색했던 사람들의 믿음과는 더욱 반대되는 것으로 판명 나는 경우가 많았던 오랜 역사를 갖고 있다.
스탑 메이킹 센스(Stop making sense)[2]
RNA를 가지고 노는 장난이 그 전에도 폭발적인 인기를 누렸던 적이 있었기에, 이에 대한 회의론이 나오는 것도 어찌 보면 당연하다. 이 분야에서 가장 오래된 기업 중 하나인 아이오니스 파마슈티컬스(Ionis Pharmaceuticals)는 1989년에 설립되었다(이 회사의 이름은 원래 Isis Pharmaceuticals였지만, 이슬람국가가 이 이름을 사용하면서 현재와 같이 바뀌었다). 이 회사의 목표는 설립 당시나 지금이나 mRNA를 이용하는 것이 아니라 그것을 억제하는 것이다.
mRNA 분자의 염기 서열은 그것의 견본 역할을 했던 유전자에서 찾을 수 있는 것과 동일한 정보를 실어 나른다. 그러나 RNA가 만들어지는 방법 덕분에, 그것은 상호 보완적인 방식으로 그 정보를 전달한다. DNA는 시토신(cytosine)을 의미하는 C라는 염기를 갖고 있고, RNA는 구아닌(guanine)을 의미하는 G를 갖게 된다. 그리고 RNA는 C를 갖고 있다가 DNA가 G를 갖게 되는 식이다. 이렇게 상호 보완적인 가닥들은 서로에게 달라붙는다. DNA 분자가 이중 나선으로 쌍을 이루고 있는 이유도 그 때문이다. 어떤 mRNA에게 보완적인 염기 서열을 갖고 있는 분자를 소개해 주면, 이 둘도 역시 달라붙어서 mRNA를 무용지물로 만든다(위 표의 마지막 항목 참조).
다시 말하지만, 도움이 되는 방식으로 작동하는 멋진 아이디어를 얻어 내는 작업은 어려운 일이었다. 아이오니스가 역배열(antisense) 약물을 시중에서 정식으로 판매하기까지는 25년이 걸렸다. 이들은 현재 세 가지의 역배열 약물을 보유하고 있다. 그중 하나인 뉴시너센(Nusinersen)은 근육 소실 질환인 소아척수성근위축증(childhood spinal muscular atrophy)에 대해서 미국에서는 2016년에, 유럽에서는 2017년에 사용이 승인되었다. 그리고 이노테센(Inotersen)은 말초 신경계를 손상시키는 트렌스티레틴 관련 유전성 아밀로이드증(hereditary transthyretin-mediated amyloidosis·hATTR)에 대해서 2018년에 승인되었다. 마지막으로 볼라네소르센(Volanesorsen)은 유럽에서 2019년에 승인되었는데, 이 약물은 신진대사로 인해서 혈액 내의 트리글리세리드(triglyceride) 지방이 지나치게 증가한 사람들에게서 그 수치를 낮춰 준다.
아이오니스는 현재 추가적으로 여러 질환들에 작용하는 37개의 역배열 분자에 대한 임상 시험을 진행하고 있다. 그중 하나인 헌팅턴병(Huntington’s disease)[3]에 대해서는 스위스의 거대 제약 회사인 로슈(Roche)와 협업하여 연구를 진행하고 있다. 또한 근위축성 축삭경화증(amyotrophic lateral sclerosis)[4]과 알츠하이머병, 파킨슨병에 대해서는 신경 질환 치료 전문 기업인 바이오젠(Biogen)과 협업하고 있고, 겸상적혈구빈혈(sickle-cell anaemia)과 유사한 혈액 질환인 베타지중해빈혈(beta thalassaemia), 그리고 낭포성 섬유증(cystic fibrosis)에 대한 임상 시험도 진행하고 있다.
이 기업은 또한 또 다른 스위스 회사인 노바티스(Novartis)와 협업하여 지질단백질(a)[(lipoprotein(a))의 수치를 낮추는 방법을 개발하고 있는데, 지질단백질(a)는 저밀도지질단백질(LDL) 콜레스테롤 중에서도 특히나 파괴적인 형태이다. 이러한 지질단백질(a) 수치는 기존의 의약품으로는 치료할 수 없다. 여기에 대한 치료약으로 알려진 펠라카센(Pelacarsen)이 현재 3상 임상 시험을 진행하면서 그 수치를 변화시킬 수 있는지를 지켜보고 있다.
화학적으로 아주 조금만 손질을 하더라도 금세 리보솜에 친화적이지 않은 상태로 변하는 mRNA 분자들과는 다르게, 역배열 분자들은 상당히 많이 변형될 수 있어서 오래 유지되게 만들 수 있다. 아이오니스의 연구진은 이 역배열 분자들이 세포 내에서 몇 달 동안 돌아다닐 수 있도록 안정화시키는 방법에 대해서 연구를 진행해 오고 있다. 이것이 중요한 이유는 아이오니스가 겨냥하고 있는 목표들의 대부분이 지속적인 치료를 요하는 만성 질환이기 때문이다. 연간 주사 횟수가 적을수록 더 나은 것이다.
생명 공학 기업들이 1990년대에 역배열 분자에 대해서 열심히 연구하는 동안, 다른 분야의 연구자들은 자연에 그것과 유사한 기술이 있다는 사실을 발견했다. 그것은 바로 소간섭 RNA(siRNA)에 의해 유도되는 유전자 침묵(gene silencing)이라는 것이다. 2000년대 초기에 생명 공학 분야에서 유전자 침묵 기술의 붐을 이끌었던 곳은 2002년 미국 매사추세츠주의 케임브리지에서 설립된 앨라일람(Alnylam)과 그 이듬해에 샌프란시스코에서 뛰어든 서나세라퓨틱스(Sirna Therapeutics)이다.
애보트(Abbott), 머크(Merck), 노바티스, 화이자, 로슈, 다케다 등 기성 제약 회사들도 이 분야에 발 벗고 나섰는데, 대표적으로는 머크가 2006년에 서나세라퓨틱스를 10억 달러(1조 1339억 원)가 넘는 금액에 인수한 것이다. 이 분야에 거의 10년 동안 관심과 돈이 쏟아졌다. 그러나 전도유망한 단서들이 많이 있었음에도 불구하고, 이를 의약품으로 만드는 데는 실패했다. 2010년대 초가 되자 파티는 끝난 듯 보였다.
비선형적, 비가시적, 포괄적
그러나 앨라일람은 춤추기를 멈추지 않았다. 2014년 그들은 머크로부터 서나세라퓨틱스가 남긴 성과를 헐값에 사들였다. 그들이 이 분야에서 처음 출시한 제품은 2018년에 선보인 hATTR 치료제인 파티시란(Patisiran)이었다. 현재는 그 외에도 기보시란(Givosiran)과 루마시란(Lumasiran)도 갖고 있는데, 이들도 역시 희소 유전 질환을 치료하는 약품이다.
이 기술을 사용해서 만든 네 번째 물질은 좀 더 폭넓은 매력을 갖고 있다. 그것은 바로 혈액 내의 LDL 콜레스테롤의 농도를 위험한 수준까지 밀어 올리는 유전성 장애를 치료하기 위해 만든 인클리시란(Inclisiran)이다. 전 세계적으로 대략 3000만 명의 사람들이 이 질환으로 고통받고 있다. 메디신스컴퍼니(Medicines Company)라는 회사가 앨라일람으로부터 인클리시란에 대한 라이선스를 받아서 이 제품을 시장에 내놓고 있다. 한편 노바티스가 2020년 1월에 메디신스컴퍼니를 97억 달러(10조 9969억 원)에 인수했는데, 지난해 말 유럽 연합에 제출된 허가 신청은 승인될 것으로 보인다.
앨라일람의 연구 개발 부문 사장인 아크섀이 베이슈나우(Akshay Vaishnaw)의 말에 의하면, 이 회사는 현재 또 다른 14개의 siRNA 약물을 임상 시험하고 있다고 한다. 이러한 약물이 대상으로 삼고 있는 것으로는 혈우병, B형 간염, 재발성 신장 결석 등이 있다. 캘리포니아의 패서디나에 소재한 애로우헤드파마슈티컬스(Arrowhead Pharmaceuticals)는 낭포성 섬유증(cystic fibrosis)을 겨냥한 것을 포함하여 여덟 가지의 잠재적 siRNA 약물을 임상 시험하고 있다. 매사추세츠의 렉싱턴에 있는 다이서나파마슈티컬스(Dicerna Pharmaceuticals)는 세 가지를 시험하고 있다.
이러한 siRNA 관련 연구는 형태와 염기 서열의 세계를 가로지르면서 이뤄진다. siRNA의 모양은 ‘RNA유도 침묵 복합체(RISC)’라 불리는 단백질들에게 꼭 들어맞는다. 그러나 이러한 siRNA의 일부는 이 복합체의 외부로 튀어나와 있다. 이 꼬리에 RNA의 염기 서열을 침묵시킬 수 있는 보완 염기 서열이 포함되어 있다. siRNA와 mRNA가 만나면, RISC에 있는 이 단백질이 전령(mRNA)을 잘게 부순다[박테리아에서 발견할 수 있는 것과 같은 방식으로 RNA가 유도하고 단백질이 실행하는 유전자 절단과 개념적으로 유사한 이 메커니즘은 현재 유전자 편집에 혁명을 일으키고 있는 크리스퍼(CRISPR, 유전자 가위) 도구의 기초이다].
식물과 무척추동물에서는 이러한 siRNA 메커니즘의 자연적인 기능이 명확하다. 바이러스와 연관된 mRNA를 잘라내는 것이다. 그러나 척추동물에게서는 그러한 기능을 제공하지는 않는 것으로 보이며, 그 대신에 무엇을 하는지에 대해서는 아무도 알지 못한다. 그런데도 의약품으로서의 유망한 가능성을 막지는 못하고 있다.
RISC와 연관된 다른 RNA들도 마찬가지이다. 예를 들어서, 마이크로 RNA(miRNA)는 자신이 가진 보완 염기 서열을 사용해서 mRNA를 파괴하는 것이 아니라 그들을 통제한다. 인간의 게놈은 이러한 miRNA를 약 2600개 포함하고 있는 것으로 보이며, 단백질을 형성하는 유전자의 약 60퍼센트가 전사(transcribe)되는 속도를 조절하는 데 관여하는 것으로 여겨진다. 이러한 몇 가지의 물질들이 치료적 목적으로 유망한 것으로 보인다.
miRNA의 활성 부위는 특정한 염기 서열에 반응하는 단일 가닥의 꼬리이기 때문에, 그것들을 겨냥하는 확실한 방법은 역배열을 사용하는 것이다. 아이오니스와 앨라일람의 협업으로 탄생한 기업인 레굴루스파마슈티컬스(Regulus Pharmaceuticals)는 miRNA가 역할을 하는 두 가지의 신장 관련 유전자 질환을 치료하기 위해서 miRNA-21을 겨냥한 역배열 분자를 개발하려 노력하고 있다. 어쨌든 miRNA를 겨냥하기 시작하면, 이제 약물 파티가 벌어지게 된다.[5] 덴마크 기업인 산타리스파마(Santaris Pharma)는 C형 간염 바이러스가 건강을 해치는 데 사용하는 miRNA-122에 대해 작용하는 역배열 억제제인 미라비르센(Miravirsen)을 개발했다. 이 약물은 현재 로슈가 소유권을 구입했다.
혁신은 계속된다. 런던에 있는 스타트업인 미나세라퓨틱스(Mina Therapeutics)는 조용히 머물러 있는 유전자를 활성화시키는 saRNA의 잠재력에 대해 연구하고 있다. 그 외에 ‘자가 증폭(self-amplifying)’ mRNA 약물을 위한 시스템을 조사하는 곳들도 있다. 이러한 mRNA들은 세포의 리보솜을 구슬려서 원래 예정된 단백질을 생산하는 것만이 아니라 RNA 복제 효소(RNA-replicase)라는 제2의 단백질도 만들도록 유도한다. RNA 복제 효소는 좀 더 많은 mRNA를 만들어서, 더욱 많은 단백질이 발현될 수 있을 것이다. 앞으로도 더욱 똑똑해지리라는 것은 분명하다.
miRNA의 활성 부위는 특정한 염기 서열에 반응하는 단일 가닥의 꼬리이기 때문에, 그것들을 겨냥하는 확실한 방법은 역배열을 사용하는 것이다. 아이오니스와 앨라일람의 협업으로 탄생한 기업인 레굴루스파마슈티컬스(Regulus Pharmaceuticals)는 miRNA가 역할을 하는 두 가지의 신장 관련 유전자 질환을 치료하기 위해서 miRNA-21을 겨냥한 역배열 분자를 개발하려 노력하고 있다. 어쨌든 miRNA를 겨냥하기 시작하면, 이제 약물 파티가 벌어지게 된다.[5] 덴마크 기업인 산타리스파마(Santaris Pharma)는 C형 간염 바이러스가 건강을 해치는 데 사용하는 miRNA-122에 대해 작용하는 역배열 억제제인 미라비르센(Miravirsen)을 개발했다. 이 약물은 현재 로슈가 소유권을 구입했다.
혁신은 계속된다. 런던에 있는 스타트업인 미나세라퓨틱스(Mina Therapeutics)는 조용히 머물러 있는 유전자를 활성화시키는 saRNA의 잠재력에 대해 연구하고 있다. 그 외에 ‘자가 증폭(self-amplifying)’ mRNA 약물을 위한 시스템을 조사하는 곳들도 있다. 이러한 mRNA들은 세포의 리보솜을 구슬려서 원래 예정된 단백질을 생산하는 것만이 아니라 RNA 복제 효소(RNA-replicase)라는 제2의 단백질도 만들도록 유도한다. RNA 복제 효소는 좀 더 많은 mRNA를 만들어서, 더욱 많은 단백질이 발현될 수 있을 것이다. 앞으로도 더욱 똑똑해지리라는 것은 분명하다.
매우 흥미진진할 것이다
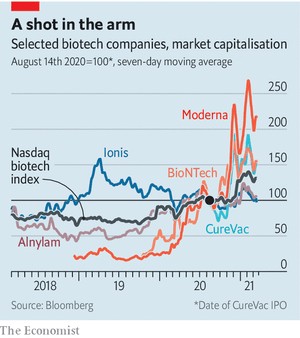
이런 가능성들의 일부만 성공을 거둔다 해도, 현재 주식 시장에서와 같은 인기 경쟁에서 좀 더 많은 사람들이 RNA에게 표를 던질 것이 확실해 보인다(표 참조). 사람들의 성원은 생명체의 가장 초기 역사에 관심을 가진 소규모의 생물학자들도 환영할 텐데, 이들은 오래전부터 RNA 분자의 진가를 일찌감치 간파하고 있었던 핵심적인 집단이다. 생명체는 신진대사를 위한 여러 반응을 촉진하기 위해 현재 무엇을 해야 하는지도 알아야 하지만, 정보를 미래에 전달하기 위한 방법도 필요하다. 현재 알려진 분자들 중에서 RNA만이 그 형태와 염기 서열의 다재다능함으로 인해서 이 두 가지 일을 모두 할 수 있다. 즉, 매일의 요구 사항을 처리하면서, 동시에 재생산을 위한 지시 사항을 판독 가능한 염기 서열의 형태로 암호화할 수 있는 것이다. 이는 초기의 생명체들은 ‘RNA의 세계’에서 상당한 시간을 보낸 이후에, 그 분업 체계가 단백질이 해야 할 일과 데이터를 DNA에 저장하는 작업을 할당하고, RNA의 지위는 그것이 창조한 세계에서의 조력자 역할로 낮추어졌음을 암시한다.
RNA의 응용은 지난 수십 년 동안 수많은 장애물에 부딪혀 왔다. 그리고 백신을 통해서 그 효능이 입증되었다고 하더라도 앞으로는 더 이상의 장애물을 만나지 않음을 의미하지는 않는다. 그러나 의학은 이제 약물이 단지 단백질만을 겨냥하는 것이 아니라, 단백질을 만들고 새로운 가능성을 열어젖히기 위한 프로세스를 목표로 겨누기 위한 방법도 갖고 있는 것으로 보인다. RNA의 다음 세상이 기다리고 있다.
[1]
마셜 맥루한(Marshall McLuhan)이 말한 “미디어는 메시지다(The medium is the message”를 패러디한 제목이다.
[2]
미국의 록 밴드 토킹 헤즈(Talking Heads)의 공연 실황을 담은 다큐멘터리 제목. 여기부터는 안티센스(antisense, 역배열) 약물을 소개하고 있기 때문에, 이런 제목을 붙였다.
[3]
뇌의 신경 세포가 퇴화하면서 발생하는 선천성 중추 신경계 질병이다.
[4]
흔히 루게릭병으로 알려져 있으며, 고(故) 스티븐 호킹 박사가 평생 앓았던 질병이다.
[5]
원문에는 “things get positively baroque”라고 되어 있는데, ‘get baroque’는 ‘친구들과 어울려서 함께 대마초를 피우다’라는 뜻의 속어이다. - 역주